 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'Oxygène et la Vie: tome II - L'Oxygène en Pathologie des Mammifères
Mitochondries et métabolisme de l’oxygène
Première partie : Mitochondries et oxygénation
Carol Deby
Cette étude n'a d'autres buts que préparer à la lecture d’importants chapitres de la pathologie contemporaine où le métabolisme de l’oxygène est impliqué, tels
- l'ischémie-reperfusion (ou anoxie-réoxygénation) dont les conséquences médicales sont d'avoir apporté les fondements d’une thérapeutique récente: le préconditionnement des patients risquant une phase d'ischémie-reperfusion ;
- l’inflammation qui couvre d’énormes pans de la pathologie ;
- l’apoptose cellulaire.
Il y a une vingtaine d'années que s'est lentement développée la certitude que la mitochondrie joue un rôle essentiel dans ces divers phénomènes.
C'est la raison pour laquelle nous avons écrit un aperçu très élémentaire de la biochimie de ces organelles, en ne nous intéressant qu'aux mécanismes mettant en jeu le métabolisme de l'oxygène, c'est-à-dire produisant des espèces oxygénées activées (ROS :reactive oxygen species), sans négliger toutefois les bases biochimiques nécessaires pour les comprendre.
Le lecteur ne trouvera pas ici un exposé général approfondi de tous les mécanismes qui font l’objet d’intenses recherches depuis presque cinquante ans. Nous ne ferons que les survoler.

George Palade : découvreur de la structure des mitochondries
Chapitre I : Généralités
Nous recommandons au lecteur novice de consulter le chapitre 13 du livre « Biologie cellulaire », de Marc Maillet, Masson, Paris, 2007.
| Note: pour la facilité de la lecture, 1. chaque référence dans le texte comprend un lien vers les pages de bibliographie 2. les abréviations et les formules chimiques sont reprises dans les pages du glossaire ; elles sont également identifiées directement dans le texte (apparition en arrière plan lors du pointage de la souris) |
1. Structure mitochondriale
Les membranes externe et interne de la mitochondrie sont constituées chacune d'un double feuillet lipidique délimitant l'espace intermembranaire. C'est dans la membrane interne que se situent les 5 complexes de la chaîne respiratoire.
La réduction de l'oxygène se produit dans l'espace matriciel.
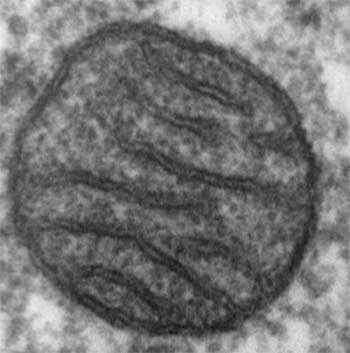
Fig I-1A : Coupe de mitochondrie en microscopie électronique par transmisssion.
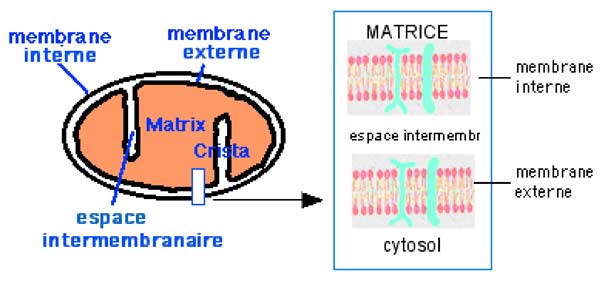
| Fig. I-1B : Schéma très simplifié d’une mitochondrie. A droite : agrandissement d’une coupe montrant le double feuillet phospholipidique constituant chaque membrane, ainsi que les protéines (en vert) les traversant (canaux de transport spécifiques). |
a. Membrane externe : La membrane externe contient plusieurs complexes protéiques qui forment des canaux transmembranaires spécifiques par lesquels diverses molécules et ions entrent et sortent de la mitochondrie. Riche en lipides, elle contient du cholestérol.
b. Membrane interne : elle est nettement plus riche en protéines que la précédente ; elle est plus pauvre en lipides, ne contient pas de cholestérol, mais de la cardiolipine. Elle contient 5 complexes protéiques intégrés à cette membrane :
- NADH déshydrogénase (Complexe I ou CoI),
- succinate déshydrogénase (Complexe II ou CoII),
- cytochrome c réductase (Complexe III ou CoIII), aussi connue comme « cytochrome b-c1 complex »),
- cytochrome c oxydase (Complexe IV ou CoIV),
- ATP synthase (ComplexeV ou CoV).
c. Matrice
Elle contient notamment les enzymes du cycle citrique et du métabolisme lipidique, les enzymes antioxydantes, le DNA monocaténaire ainsi que des ribosomes mitochondriaux non organisés en ergastoplasme, et des RNA messagers.
2. DNA mitochondrial (mitDNA)
Voir Saccone et al., 1991.
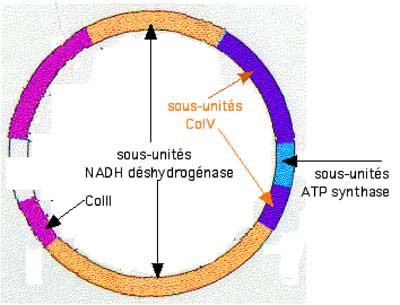
Fig. I-2 : Schéma très élémentaire d’une chaîne monocaténaire de DNA mitochondrial. Sont omis les t-RNA et les sections non en rapport direct avec la respiration mitochondriale. Ce DNA monocaténaire n’est pas cyclique, comme pourrait le faire supposer la figure. |
Les mitochondries humaines contiennent 5 à 10 molécules identiques de DNA monocaténaire, consistant chacune en 16.569 paires de base transportant les informations pour 37 gènes qui encodent :
• 2 molécules différentes de RNA ribosomial (rRNA),
• 22 molécules différentes de RNA de transfert (tRNA) (au moins un pour chaque aminoacide),
• 13 polypeptides.
Les molécules de rRNA et de tRNA sont utilisées dans la machinerie qui synthétise les 13 polypeptides.
Les 13 polypeptides participent à la synthèse de divers complexes protéiques situés dans la membrane interne de la mitochondrie :
* 7 sous-unités participant à la synthèse de la NADH déshydrogénase mitochondriale,
* 3 sous-unités de la cytochrome c oxydase (CoIV),
* 2 sous-unités d'ATP synthase,
* le cytochrome b (partie du CoIII).
Chacun de ces complexes protéiques requiert également des sous-unités qui sont encodées par des gènes nucléaires, synthétisées dans le cytosol et importées de celui-ci dans la mitochondrie. Les gènes nucléaires encodent aussi 900 autres protéines qui doivent être importées dans la mitochondrie. Rappelons que c’est en 1959 que fut observé pour la première fois du DNA monocaténaire, par Chèvremont, de l’Université de Liège.
Une recherche en plein développement : l’adressage (« protein adressing »)
Il est appelé aussi ciblage postraductionnel des protéines vers les organelles (Pollard et Earnshaw, 2004).
Les protéines synthétisées par les ribosomes cytosoliques (Voos et al., 1999) seront exportées dans diverses directions, munies d’une séquence constituant une adresse. Les travaux ont été commencés sur une levure (eucaryote) et on considère que les résultats sont transposables aux cellules des mammifères. Des protéines venues des mitochondries se lient à la protéine à adresser vers cette organelle : ce sont les signaux d’adressage qui lui permettront de franchir les membranes mitochondriales (voir chapitre V).
Mutations génomiques : voir Ozawa, 1995 et 1999.
3. Ribosomes mitochondriaux (mitoribosomes)
Les mitoribosomes ont une structure relativement poreuse qui dans l'ensemble est différente des ribosomes cytosoliques (Sharma et al., 2003). Rappelons que les mitoribosomes sont épars dans la matrice.
4. Chaîne de transport d'électrons (ETC)
Elle assume la réduction instantanée de l’oxygène et fournit l’énergie à l’ATP synthase
Elle consiste en :
a) 4 protéines intégrées à la membrane interne
• complexe I ou NADH déshydrogénase ou NADH-CoQ oxydoréductase
• complexe II ou succinate déshydrogénase
• complexe III ou cytochrome c réductase
• complex IV ou cytochrome c oxydase
b) 2 petites molécules
• ubiquinone
• cytochrome c
5. ATP synthase
Elle est étroitement couplée à la chaîne de transport d’électrons avec laquelle elle réalise la phosphorylation oxydative produisant l’ATP.
L’ETC et la phosphorylation oxydative sont traitées au chapitre II.
6. Les mécanismes régulateurs
a) Régulation de l’ETC et de la phosphorylation oxydative
Il peut se produire un découplage des deux phénomènes. La production d’ATP a un frénateur principal : le monoxyde d’azote (•NO).
Une étude de ces systèmes homéostasiques est détaillée dans le chapitre III.
b) Les enzymes antioxydantes
Ce sont des agents protéiques abaissant le taux des ROS (reactive oxygen species) lorsque celui-ci modifie la balance redox. Cette balance est une des propriétés très importantes de la cellule, et particulièrement des mitochondries. Nous consacrons à l’homéostasie de la balance redox le chapitre IV. Les ROS sont considérées maintenant comme des facteurs physiologiques normaux (voir chapitre VI). Les enzymes antioxydantes (principalement thiolées) font l’objet du chapitre VIII.
c) Régulation mitochondriale des entrées et sorties de molécules
Elles s’opèrent par des canaux spécifiques des membranes externe et interne de la mitochondrie. Nous étudions ces structures de transport dans le chapitre V.
c) Autres mécanismes biochimiques
D'autres mécanismes biochimiques importants ne seront pas traités dans cette étude, car ils n’impliquent pas directement le métabolisme de l’oxygène. Citons entre autres :
- le cycle de Krebs (cycle des acides tricarboxyliques)
- le cycle d’oxydation des acides gras (cycle de Lynen)
- la synthèse des porphyrines et des hèmes. Dès 1969, MS Jones et OT Jones démontraient le rôle essentiel des mitochondries dans la biosynthèse des hèmes. On complètera ces connaissances par la suite. En bref, la condensation de la glycine et du succinyl-coenzyme A pour former le 5-aminolevulinate (ALA), premier stade de la biosynthèse des hèmes, se produit dans la mitochondrie. Le composé ALA retourne dans le cytosol pour devenir un uroporphyrinogène, après intervention d’au moins 5 enzymes cytosoliques. Ce précurseur rentre alors dans la mitochondrie où il deviendra une porphyrine. C’est dans la matrice mitochondriale que se fera l’incorporation du fer pour la genèse de l’hème final (Moore, 1998; Jones et Jones, 1969).
- la synthèse des hormones stéroïdiennes (voir Brookes et al., 2004).
7. Rôle des mitochondries dans l’apoptose
L’apoptose est la destruction du noyau cellulaire entraînant la mort de la cellule. Elle est très différente de la nécrose, due à une agression de l’organisme.
C’est un processus capital dans l’embryogenèse (résorption d’organes ébauchés durant le développement de l’embryon, souvenirs de la phylogénie), dans la lutte contre les cellules se développant anarchiquement (tumeurs). Les mitochondries participent activement à ces mécanismes. Des situations pathologiques comme l’ischémie-reperfusion entraînent l’apoptose accidentelle des cellules. Le signal apoptotique est, dans ces cas, le plus souvent d’origine mitochondriale. Le chapitre VII est entièrement consacré à ce rôle des mitochondries.
8. Panorama des fonctions mitochondriales
a) Génération de l'ATP et de l’énergie nécessaire au métabolisme (chapitre II)
b) Thermogenèse (Zhou et al., 2001)
c) Homéostasie du calcium intracellulaire (Orrenius et al., 2003)
d) Homéostasie du fer (non traitée ici) (Napier et al., 2005)
e) Génération de ROS jouant un rôle régulateur dans la signalisation (chapitre VI)
f) Antioxydation catalytique par enzymes (chapitre VIII)
g) Induction de l'apoptose (Green et Kroemer, 2004).
Mitochondries et oxygénation - Chapitre II:Phosphorylation oxydative |
Troubles de l'oxygénation et mitochondries - Sommaire |
Mitochondries et métabolisme de l'oxygène - Introduction |
 |
 |
 |